
Модели атома Томпсона и Резерфорда
Исторические взгляды на атом
Представление об атомах как неделимых мельчайших частицах вещества («атомос» — неразложимый) возникло еще в античные времена (Демокрит, Эпикур, Лукреций).

Демокрит (460-370 гг. до н.э.)
В средние века, во времена безграничного господства церкви, учение об атомах, будучи материалистическим, естественно, не могло получить признания, а тем более дальнейшего развития. К началу XVIII в. атомистическая теория приобретает все большую популярность, так как к этому времени в работах А. Лавуазье (1743—1794, французский химик), М. В. Ломоносова и Д. Дальтона была доказана реальность существования атомов. Однако в это время вопрос о внутреннем строении атомов даже не возникал, так как атомы по-прежнему считались неделимыми.
Большую роль в развитии атомистической теории сыграл Д. И. Менделеев, разработавший в 1869 г. Периодическую систему элементов, в которой впервые на научной основе был поставлен вопрос о единой природе атомов. Во второй половине XIX века экспериментально было доказано, что электрон является одной из основных составных частей любого вещества. Эти выводы, а также многочисленные экспериментальные данные привели к тому, что в начале XX века серьезно встал вопрос о строении атома.
Модель атома Томпсона
Первая попытка создания на основе накопленных экспериментальных данных модели атома принадлежит Дж. Дж. Томсону (1903).

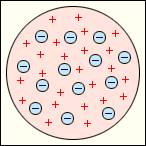
Согласно этой модели, атом представляет собой непрерывно заряженный положительным зарядом шар радиусом порядка 10–10 м, внутри которого около своих положений равновесия колеблются электроны; суммарный отрицательный заряд электронов равен положительному заряду шара, поэтому атом в целом нейтрален (кекс с изюмом). Через несколько лет было доказано, что представление о непрерывно распределенном внутри атома положительном заряде ошибочно.
Опыты Резерфорда

В развитии представлений о строении атома велико значение опытов английского физика Э. Резерфорда (1871—1937) по рассеянию a-частиц в веществе. Альфа-частицы возникают при радиоактивных превращениях; они являются положительно заряженными частицами с зарядом 2е и массой, примерно в 7300 раз большей массы электрона. Пучки a-частиц обладают высокой монохроматичностью (для данного превращения имеют практически одну и ту же скорость (порядка 107 м/с)).
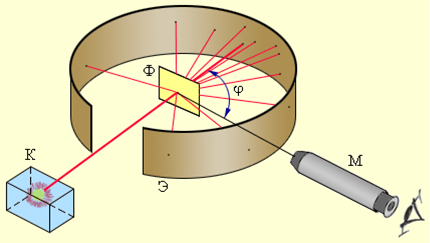
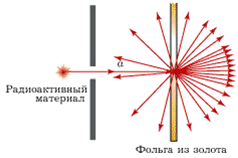
Схема опыта Резерфорда по рассеянию α-частиц.
K – свинцовый контейнер с радиоактивным веществом,
Э – экран, покрытый сернистым цинком,
Ф – золотая фольга,
M – микроскоп.
От радиоактивного источника, заключенного в свинцовый контейнер, α-частицы направлялись на тонкую металлическую фольгу. Рассеянные частицы попадали на экран, покрытый слоем кристаллов сульфида цинка, способных светиться под ударами быстрых заряженных частиц. Сцинтилляции (вспышки) на экране наблюдались глазом с помощью микроскопа. Наблюдения рассеянных α-частиц в опыте Резерфорда можно было проводить под различными углами φ к первоначальному направлению пучка. Было обнаружено, что большинство α-частиц проходит через тонкий слой металла, практически не испытывая отклонения. Однако небольшая часть частиц отклоняется на значительные углы, превышающие 30°. Очень редкие α-частицы (приблизительно одна на десять тысяч) испытывали отклонение на углы, близкие к 180°.

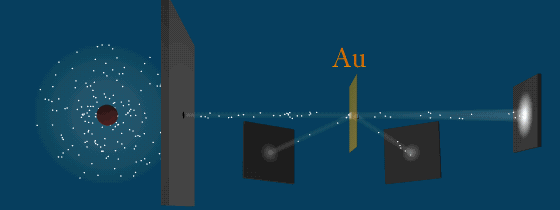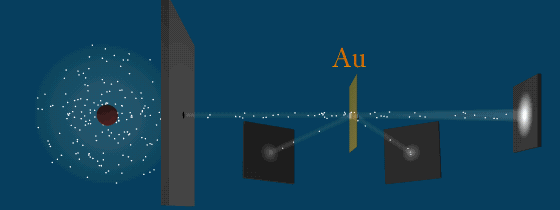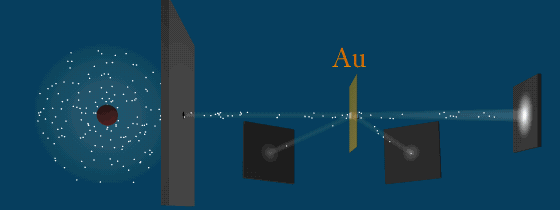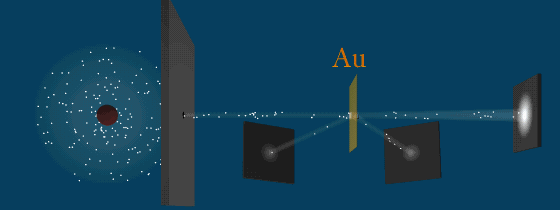
Результаты опыта
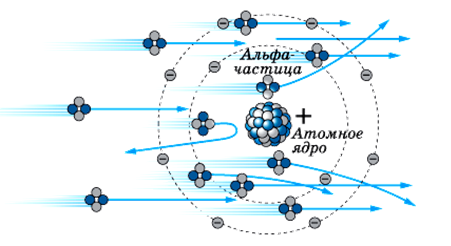
Почему α-частицы отклоняются по-разному. Модель Томпсона не могла объяснить это явление. Следовательно, атом не может иметь положительный заряд равномерно распределенный по всей сфере.
Резерфорд понял, что α-частица могла быть отброшена назад лишь в том случае, если положительный заряд атома и его масса сконцентрированы в очень малой области пространства.
Он пришел к мысли о существовании атомного ядра – тела малых размеров, в котором сконцентрированы почти вся масса и весь положительный заряд атома.
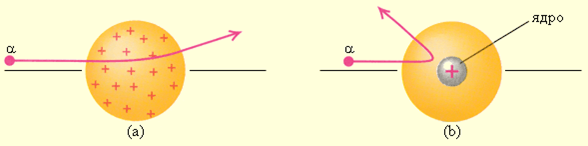
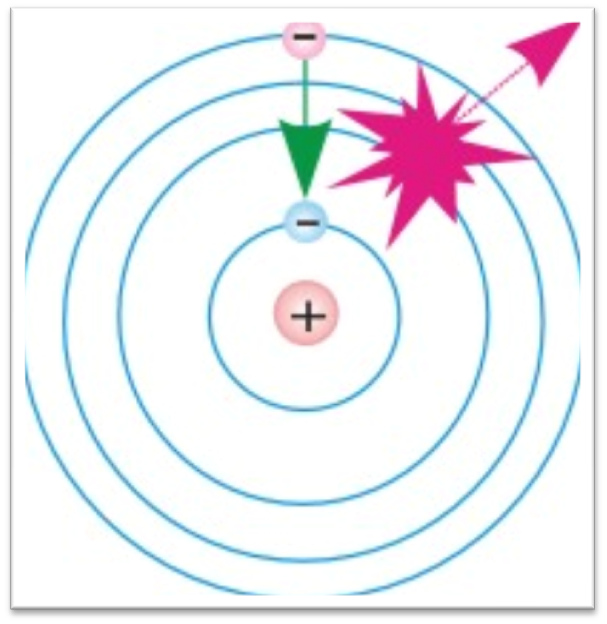
Рассеяние α-частицы в атоме Томсона (a) и в атоме Резерфорда (b).
Модель атома Резерфорда
На основании своих исследований Резерфорд в 1911 г. предложил ядерную (планетарную) модель атома.
Согласно этой модели, вокруг положительного ядра, имеющего заряд Zе (Z — порядковый номер элемента в системе Менделеева, е — элементарный заряд), размер 10–15—10–14 м и массу, практически равную массе атома, в области с линейными размерами порядка 10–10 м по замкнутым орбитам движутся электроны, образуя электронную оболочку атома.
Так как атомы нейтральны, то заряд ядра равен суммарному заряду электронов, т. е. вокруг ядра должно вращаться Z электронов.
На 180° отклонялись те α-частицы, которые летели близко к ядру, совсем не отклонялись частицы, летящие далеко от ядра?
Модель атома водорода
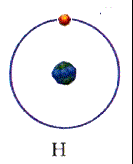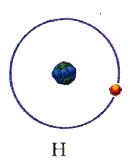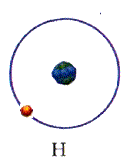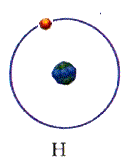
Для простоты предположим, что электрон движется вокруг ядра по круговой орбите радиуса r. При этом кулоновская сила взаимодействия между ядром и электроном сообщает электрону центростремительное ускорение. Второй закон Ньютона для электрона, движущегося по окружности под действием кулоновской силы, имеет вид
![]() , (1)
, (1)
где me, и v — масса и скорость электрона на орбите радиуса r, e0 — электрическая постоянная.
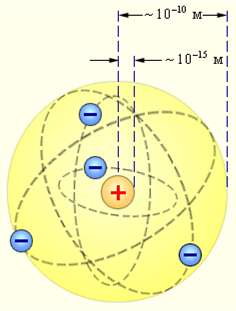
Трудности планетарной модели Резерфорда
Уравнение (1) содержит два неизвестных: r и v. Следовательно, существует бесчисленное множество значений радиуса и соответствующих ему значений скорости (а значит, и энергии), удовлетворяющих этому уравнению. Поэтому величины r, v (следовательно, и Е) могут меняться непрерывно, т. е. может испускаться любая, а не вполне определенная порция энергии. Тогда спектры атомов должны быть сплошными. В действительности же опыт показывает, что атомы имеют линейчатый спектр. Согласно классической электродинамике, ускоренно движущиеся электроны должны излучать электромагнитные волны и вследствие этого непрерывно терять энергию. В результате электроны будут приближаться к ядру и в конце концов упадут на него. Таким образом, атом Резерфорда оказывается неустойчивой системой, что опять-таки противоречит действительности.
Попытки построить модель атома в рамках классической физики не привели к успеху: модель Томсона была опровергнута опытами Резерфорда, ядерная же модель оказалась неустойчивой электродинамически и противоречила опытным данным. Преодоление возникших трудностей потребовало создания качественно новой — квантовой — теории атома.
Теория Бора
Планетарная модель атома Резерфорда натолкнулась на принципиальные трудности. Согласно классической электродинамике, заряженная частица, движущаяся с ускорением, непрерывно излучает электромагнитную энергию. Поэтому электроны, двигаясь вокруг ядра, т. е. ускоренно, должны были бы непрерывно терять энергию на излучение. Но при этом они за ничтожную долю секунды потеряли бы всю свою кинетическую энергию и упали бы на ядро.
Противоречия модели Резерфорда оказалось возможным разрешить, лишь отказавшись от ряда привычных представлений классической физики. Важнейший шаг в построении теории атома был сделан датским физиком Н. Бором (1913).

Постулаты Бора и модель атома Бора
В основу квантовой теории атома Бор положил 2 постулата, характеризующих те свойства атома, которые не укладывались в рамки классической физики. Эти постулаты Бора могут быть сформулированы следующим образом:
1 постулат: атомная система может находиться только в особых стационарных или квантовых состояниях, каждому из которых соответствует определенная энергия En. В стационарных состояниях атом не излучает.
2 постулат: при переходе атома из одного стационарного состояния с энергией En в другое стационарное состояние с энергией Em излучается или поглощается квант, энергия которого равна разности энергий стационарных состояний:
hv = En – Em,
где h – постоянная Планка.
Согласно теории Бора энергия электрона в атоме водорода, находящегося на n-м энергетическом уровне, равна:
![]()
При испускании или поглощении света изменяется энергия атома, это изменение равно энергии испущенного или поглощённого фотона, т. е. имеет место закон сохранения энергии.
Свои постулаты Бор применил для построения теории простейшей атомной системы — атома водорода. Основная задача состояла в нахождении частот электромагнитных волн, излучаемых водородом. Эти частоты можно найти на основе второго постулата и правила определения стационарных значений энергии атома. Это правило (так называемое правило квантования) Бору опять-таки пришлось постулировать.
Переход электрона с одной орбиты на другую при поглощении и испускании кванта света:
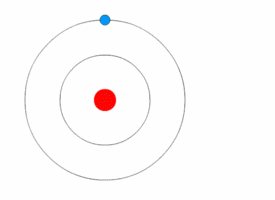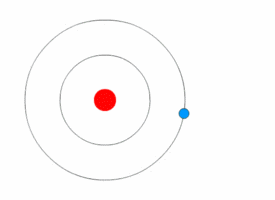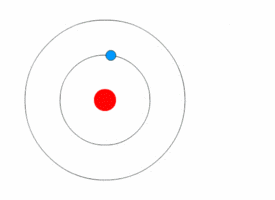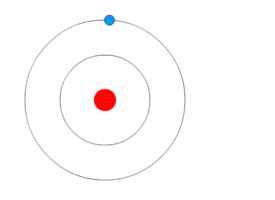
Модель атома водорода по Бору.
Используя законы механики Ньютона и правило квантования, на основе которого определяются возможные стационарные состояния атома. Бор смог вычислить радиусы орбит электрона и энергии стационарных состояний атома. Минимальный радиус орбиты определяет размеры атома. На рисунке значения энергий стационарных состояний (в электрон-вольтах) отложены на вертикальной оси.
Второй постулат Бора позволяет вычислить по известным значениям энергий стационарных состояний, частоты излучений атома водорода.
В атомной физике энергию принято выражать в электронвольтах (сокращенно эВ). 1 эВ равен энергии, приобретаемой электроном при прохождении им разности потенциалов 1 В: 1 эВ = 1,6 . 10 Дж.
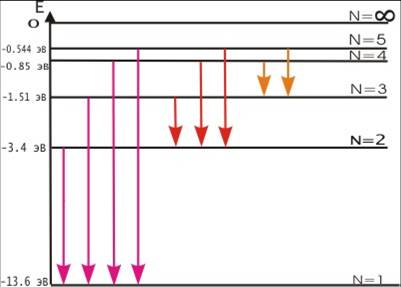
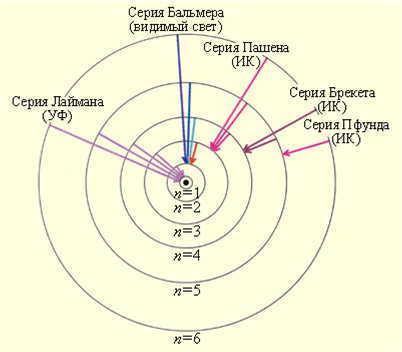
Теория Бора приводит к количественному согласию с экспериментом для значений этих частот. Все частоты излучений атома водорода составляют в своей совокупности ряд серий, каждая из которых образуется при переходах атома в одно из энергетических состояний со всех верхних энергетических состояний (состояний с большей энергией).
Переходы в первое возбужденное состояние (на второй энергетический уровень) с верхних уровней образуют серию Бальмера.
![]()
Данная серия названа по имени швейцарского учителя И. Бальмера, который еще в 1885 г. на основе экспериментальных данных вывел простую формулу для определения частот видимой части спектра водорода.
Поглощение света. Поглощение света — процесс, обратный излучению. Атом, поглощая свет, переходит из низших энергетических состояний в высшие. При этом он поглощает излучение той же самой частоты, которую излучает, переходя из высших энергетических состояний в низшие.
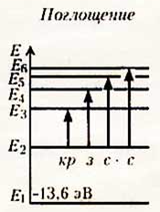
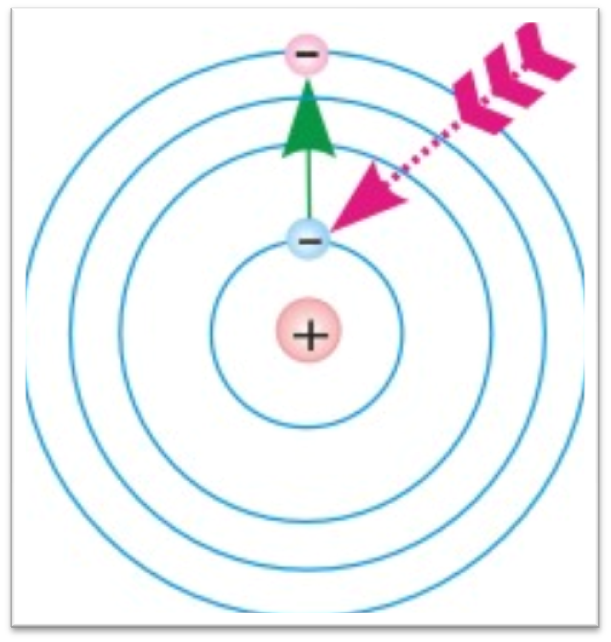
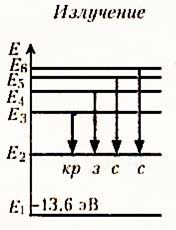
На основе двух постулатов и правила квантования Бор определил радиус атома водорода и энергии стационарных состояний атома. Это позволило вычислить частоты излучаемых и поглощаемых атомом электромагнитных волн.
![]() -
радиус
n-ой
орбиты
-
радиус
n-ой
орбиты
![]() -
скорость электрона на
n-ой
орбите
-
скорость электрона на
n-ой
орбите
![]() - период вращения электрона
- период вращения электрона
Дальнейшее развитие атомной физики показало справедливость постулатов Бора не только для атомов, но и для других микроскопических систем — для молекул и для атомных ядер. Эти постулаты следует рассматривать как твёрдо установленные опытные квантовые законы. Они составляют ту часть теории Бора, которая не только сохранилась при дальнейшем развитии квантовой теории, но и получила своё обоснование. Иначе обстоит дело с моделью атома Бора, основанной на рассмотрении движения электронов в атоме по законам классической механики при наложении дополнительных условий квантования. Такой подход позволил получить целый ряд важных результатов, но был непоследовательным: квантовые постулаты были присоединены к законам классической механики искусственно.
Примеры решения задач:
Задача 1. Определить частоту обращения электрона в атоме водорода для первой и второй орбит.
Дано:
mе = 9,1·1031 кг
n = 1
n = 2
f -?
Решение:
Электрон вращается вокруг ядра по круговой орбите, поэтому по второму закону Ньютона и учитывая формулы для центростремительного ускорения имеем:
С другой стороны между электроном и ядром действуют силы Кулоновского взаимодействия: . Так как это одна и та же сила, то приравниваем:
,
e – заряд электрона
Задача 2. Определить частоту излучения атома водорода при переходе электронов со второй орбиты на первую.
Дано:
mе = 9,1·1031 кг
n1 = 2
n2 = 1
f -?
Решение:
При переходе электронов с одной орбиты на другую длина волны излучения атома
Задачи для самостоятельного решения
1. Определить частоту излучения атома водорода при переходе электронов со второй орбиты на первую.
2. Чему равна энергия электрона, находящегося на третьей орбите в атоме водорода
3. Определить длину волны излучения атомом водорода при переходе электронов с четвертой орбиты на вторую. Какому цвету соответствует волна.
Вопросы:
1. Какая модель атома принята в качестве основной?
2. Почему она названа планетарной?
3. Цель опыта Резерфорда, элементы экспериментальной установки,
4. Условия осуществления, этапы проведения опыта, результаты
5. Плюсы и минусы модели атома Резерфорда
6. Сформулировать постулаты Бора.
7. Найти противоречия постулатов с законами классической физики.
8. Что представляла собой модель атома водорода по Бору?
9. Какие две теории были созданы для объяснения свойств строения атомов?
10. Какое излучение наблюдается при переходах электрона в атоме водорода на
второй энергетический уровень?
Домашнее задание:
Задачи:
Вычислить радиус первой и второй орбиты атома водорода (боровский радиус) и скорость электрона на этой орбите
Контрольные вопросы:
1. Почему отрицательно заряженные частицы атома не оказывают заметного влияние на рассеявание α-частиц?
2. Почему α-частицы не могли бы рассеиваться на большие углы, если бы положительный заряд атома бал распределен по всему объему?
3. Почему планетарная модель атома не согласуется с законами классической физики?
4. В чем заключаются противоречия между постулатами Бора и законами классической механики и классической электродинамики?
5. Какое излучение наблюдается при переходе электрона в атоме водорода на второй энергетический уровень?