
Количество теплоты
Теплообмен и теплопередача
Изменить внутреннюю энергию газа в цилиндре можно, не только совершая работу, но и нагревая газ.
Если закрепить поршень, то объем газа при нагревании не меняется и работа не совершается.


Но температура газа, а следовательно, и его внутренняя энергия возрастают.
Процесс передачи энергии от одного тела к другому без совершения работы называют теплообменом или теплопередачей.
Виды теплопередачи:
1) излучение
2) конвенция
3) теплопроводность
Понятие количество теплоты.
Количественную меру изменения внутренней энергии при теплообмене называют количеством теплоты. Количеством теплоты называют также энергию, которую тело отдает в процессе теплообмена.
Количеством теплоты обозначается буквой - Q.
Количество теплоты – это физическая величина, показывающая, какая энергия передана телу в результате теплообмена.
В международной системе единицей количества теплоты, также как работы и энергии, является джоуль: [Q] = [A] = [E] = 1 Дж.
На практике еще иногда применяется внесистемная единица количества теплоты – калория. 1 кал. = 4,2 Дж.
Молекулярная картина теплообмена.
При теплообмене на границе между телами происходит взаимодействие медленно движущихся молекул холодного тела с быстро движущимися молекулами горячего тела. В результате кинетические энергии молекул выравниваются и скорости молекул холодного тела увеличиваются, а горячего — уменьшаются.
При теплообмене не происходит превраения энергии из одной формы в другую, часть внутренней энергии горячего тела передается холодному телу.
Опыт:
Кнопки прикреплены к металлическому пруту парафином. При нагревании парафин плавится и кнопки отваливаются
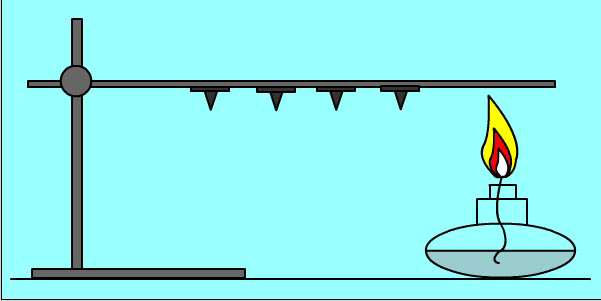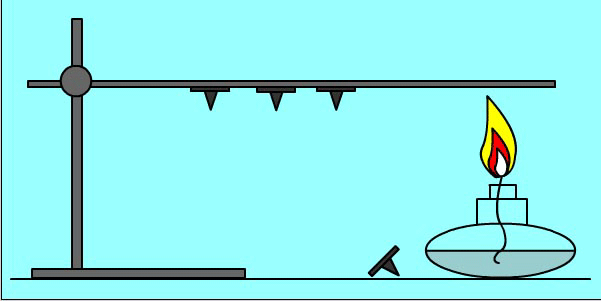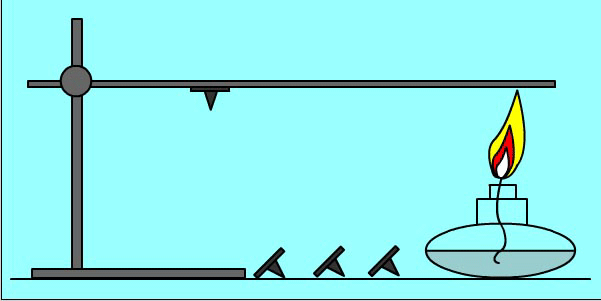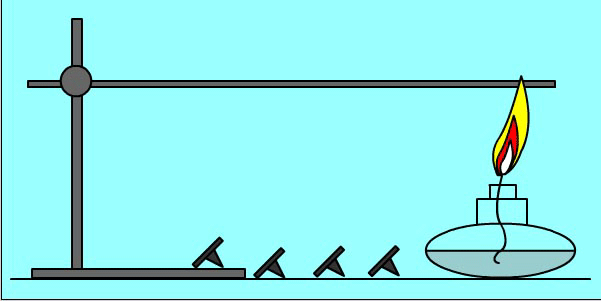
Количество теплоты при теплообмене
Количество теплоты, передаваемое от одного тела к другому, может идти на нагревание тела, плавление, парообразование, либо выделяться при противоположных процессах – остывании тела, кристаллизации, конденсации. Теплота выделяется при сгорании топлива.
Между массой вещества и количеством теплоты, необходимым для его нагревания, существует прямая пропорциональная зависимость.
Количество теплоты, необходимое для нагревания тела или выделяющееся при его охлаждении, прямо пропорционально массе тела и изменению его температуры. Q = cmΔT
Количество теплоты, необходимое для превращения жидкости в пар или выделяющееся при его конденсации, прямо пропорционально массе жидкости.
Q = rm
Количество теплоты, необходимое для плавления тела или выделяющееся при его кристаллизации, прямо пропорционально массе этого тела.
Q = λm.
Количество теплоты, выделяющееся при сгорании топлива, прямо пропорционально его массе.
Q = qm
Во всех формулах, позволяющих рассчитывать количество теплоты для различных тепловых процессов, стоят коэффициенты пропорциональности, называемые удельными величинами, то есть приходящимися на единицу других величин. Удельные величины являются характеристиками веществ, а не тел.
Удельная теплоемкость вещества показывает, чему равно количество теплоты, необходимое для нагревания или выделяющееся при охлаждении 1 кг вещества на 1 К.
Удельные теплоты парообразования, плавления, сгорания показывают, какое количество теплоты требуется для парообразования, плавления или выделяется при конденсации, кристаллизации, сгорании 1 кг вещества.
Чтобы получить единицы удельных величин, их надо выразить из соответствующих формул и в полученные выражения подставить единицы теплоты – 1 Дж, массы – 1 кг, а для удельной теплоемкости – и 1 К.
Получаем единицы: удельной теплоемкости – 1 Дж/кг·К, остальных удельных теплот: 1 Дж/кг.
Адиабатный процесс. Уравнение теплового баланса
Адиабатный процесс — это процесс, происходящий без теплообмена системы с окружающей средой, т.е. Q = 0.
Теплообмен в изолированной системе. Рассмотрим теплообмен внутри системы, состоящей из нескольких тел, имеющих первоначально различные температуры, например теплообмен между водой в сосуде и опущенным в воду горячим железным шариком. Будем считать, что система достаточно изолирована от окружающих тел и ее внутренняя энергия не изменяется (изолированная система). Никакой работы внутри этой системы не совершается. Тогда изменение энергии любого тела системы равно количеству теплоты, отданной или полученной этим телом до наступления теплового равновесия внутри системы: ΔU = Q. Складывая подобные выражения для всех тел системы и учитывая, что суммарная внутренняя энергия не меняется (ΔU1 + ΔU2 + ΔU3 + ... = 0), получим следующее уравнение: Q1 + Q2 + Q3 + …… = 0.
Это уравнение носит название уравнения теплового баланса. Здесь
Q1,
Q2,
Q3
— количества теплоты,
полученные или отданные телами.
Теплоемкость
Теплоемкость термодинамической системы называют количество теплоты, которое нужно сообщить т.д.с, чтобы изменить ее температуру на 10С
Для газов удобно пользоваться молярной теплоемкостью.
Молярной теплоемкостью системы называют количество теплоты, которое нужно сообщить одному молю идеального газа, чтобы изменить ее температуру на 10С
[Cμ] = Дж/(моль×К).
Формулы связи:
Если одинаковым по массе телам из разных веществ передать одно и тоже количество теплоты, то они нагреются до разной температуры. Вещество с меньшей теплоемкостью нагреется сильнее, а вещество с большей - слабее
Теплоемкость при постоянном давлении и объеме
Теплоемкость различается в зависимости от того, при каких условиях происходит нагревание тела — при постоянном объеме или при постоянном давлении.
Если нагревание тела происходит при постоянном объеме, т.
е. ΔV = 0, то работа равна нулю. В этом случае передаваемое телу тепло
идет только на изменение его внутренней энергии, ΔQ = ΔU,
и в этом случае молярная теплоемкость равна изменению внутренней энергии при
изменении температуры на 1 К, т. е
Поскольку для газа
Эта формула определяет теплоемкость 1 моля идеального газа, называемую молярной.
Удельная теплоемкость при постоянном давлении равна
При нагревании газа при постоянном давлении его объем меняется, сообщенное телу тепло идет не только на увеличение его внутренней энергии, но и на совершение работы, т.е. ΔQ = ΔU + PΔ V.
Молярная теплоемкость при постоянном давлении
Для идеального газа PV = RT и поэтому PΔV = RΔT.
Учитывая это, найдем
Молярная теплоемкость при постоянном давлении
Удельная
теплоемкость при постоянном давлении равна
Примеры решения задач
Задача 1: Смешали 39л воды при 200С и 21л воды при 600С. Определите температуру смеси (447Г).
Дано:
V1=39 л = 39·10-3м3
t1=200 С,
V2 = 21л = 21·10-3м3,
t2=600 C,
t−?
Решение задачи:
Понятно, что объем воды V2, имеющий более высокую температуру t2, после смешения передаст часть теплоты объему воды V1 c более низкой температурой t1, которая за счёт этой теплоты нагреется.
В конце вся вода будет иметь некоторую температуру t.
Запишем уравнение теплового баланса: Q1+ Q2 =0
Здесь Q1 – количество теплоты, полученное водой объемом V1 при нагревании до температуры t, Q1 = cm1(t–t1)
а Q2 – количество теплоты, отданное водой объемом V2 при охлаждении до температуры t.
Q2 = - cm2(t – t2)
cm1(t–t1) - cm2(t–t2) = 0
Выразим массы как произведение плотности воды на объем m = ρ·V, тогда:
cρV1(t – t1) = cρV2(t2 – t)
V1(t–t1) = V2(t2 – t)
Теперь раскроем скобки, в одной части равенства соберем все члены с множителем t, вынесем его за скобки и выразим его.
V1t–V1t1 = V2t2–V2t
V1t + V2t = V2t2 + V1t1
t(V1 + V2) = V2t2 + V1t1
Задача 2: Чугунный брусок и массой 0,2 кг, предварительно нагретый, опускают в сосуд, содержащий 0.8 кг керосина при температуре 150С. Окончательная температура керосина устанавливается 200С. Определите первоначальную температуру бруска (357Г).
Дано:
m1 = 0.2 кг
m2 = 0.8 кг
t1к = 150 С
t2к = 200 С,
t1б -?
Решение: запишем уравнение теплового баланса Q1 + Q2 = 0
c1m1(t2к - t1к) + c1m1(t2к - t1б) = 0
-c1m1(t2к - t1б) = c1m1(t2к - t1к)
- 540·0.2(20 - t1б) = 2100·0.8 (20-15)
-108 (20- t1б) = 8400
-20 + t1б =700/9
t1б =700/9 +20 = 97.777 =98 С
Задачи для самостоятельного решения:
1. Во сколько раз количество теплоты, которое идет на нагревание газа при постоянном давлении, больше работы, совершаемой газом при расширении? Удельная теплоемкость газа при постоянном давлении ср, молярная масса М.
2. В калориметр с теплоемкостью 63 Дж/К было налито 250 г масла при 12 °С. После опускания в масло медного тела массой 500 г при 100 °С установилась общая температура 32°С. Какова удельная теплоемкость масла по данным опыта?
3. Для приготовления ванны вместимостью 200 л смешали холодную воду при 10 °С с горячей при 60 0С. Какие объемы той и другой воды надо взять, чтобы температура установилась 40 °С?
4. Трамвайный вагон массой 12,5·103 кг, имеющий скорость 28,8 км/ч тормозит и останавливается. На сколько градусов нагреются его 8 чугунных тормозных колодок, если масса каждой его колодки 9 кг и на их нагревание затрачивается 60% кинетичекой энергии вагона?
Составить план изучения величины – количество теплоты.
Пункты плана:
1. Какое явление и свойство тел (веществ) характеризует данная величина.
2. Определение величины.
3. Определительная формула (для производной величины – формула, выражающая связь данной величины с другими).
4. Какая величина – скалярная или векторная.
5. Единица величины в СИ.
6. Способы измерения величины
Домашнее задание:
Контрольные вопросы:
1. Что называют количеством теплоты?
2. От чего зависит удельная теплоемкость вещества?
3. Что называют удельной теплотой парообразования?
4. Что называют удельной теплотой плавления?
5. В каких случаях количество теплоты положительная величина, а в каких случаях отрицательная?
Задача:
В сосуд, содержащий 1,5 кг воды при 15 °С, впускают 200 г водяного пара при 100 °С. Какая общая температура установится после конденсации пара?